
Harvard-Forscher Harald Ott
Harvard-Forscher Harald Ott
Harvard-Forscher Harald Ott: "Das ist kein Horror!"
profil: Die Medien bezeichnen Sie als "Dr. Frankenstein". Wie gefällt Ihnen das? Ott: Es ist wichtig, dass man unsere Forschung den Menschen näherbringt. Die Wissenschaft wird immer komplexer, spezialisierter. Wir haben das Glück, dass unsere Arbeiten in der Literatur in gewisser Weise schon vorhergesehen wurden, ähnlich wie bei Jules Verne.
profil: Der Titel "Dr. Frankenstein" rückt Sie in die Nähe von Horrorfantasien. Sie aber wollen Gutes tun, indem Sie Organe züchten, die irgendwann als gesunde Ersatzteile für chronisch kranke Menschen dienen sollen. Ott: Insofern ist die Metapher eine Möglichkeit, die Menschen wachzurütteln und ihnen zu erklären, dass es kein Horror ist, sondern im Gegenteil etwas sehr Positives sein wird.
profil: Ihr Ausgangspunkt ist, dass viele Patienten auf der Warteliste für ein Spenderorgan versterben, weil es zu wenige solcher Organe gibt. Ott: Die Medizin hat sich in den vergangenen 20,30 Jahren mehr und mehr darauf spezialisiert, Therapien gegen akute Erkrankungen und Verletzungen zu entwickeln, damit Patienten etwa einen Herzinfarkt, einen lebensbedrohlichen Unfall oder eine Infektion überleben, oft mit permanent eingeschränkten Funktionen. Von daher kommt der Impetus unserer Forschung: Die Dinge zu reparieren ist ja schön und gut, aber gibt es nicht eine Möglichkeit, die Organe, die ihre Funktion verlieren, auszutauschen?
profil: Und Sie sind überzeugt davon, dass das eines Tages funktionieren wird? Ott: Auf jeden Fall. Wir müssen jedoch noch viele Fragen klären, um ans Ziel zu kommen.
profil: Könnte die Organzüchtung in Zukunft auch dazu beitragen, dass die Menschen länger leben? Ott: Diese Frage taucht immer wieder in Diskussionen auf. Dabei wird vergessen, dass so viele Menschen während ihrer Lebenszeit eine eingeschränkte Lebensqualität haben, weil die Wahrscheinlichkeit, dass eines unserer Organe versagt, sehr hoch ist. Es geht also weniger darum, die Lebensdauer auf 120 Jahre auszudehnen, sondern all den Menschen zu helfen, die beispielsweise wegen einer Nierenerkrankung mit 60 an der Hämodialyse hängen oder an den Rollstuhl gefesselt bleiben.
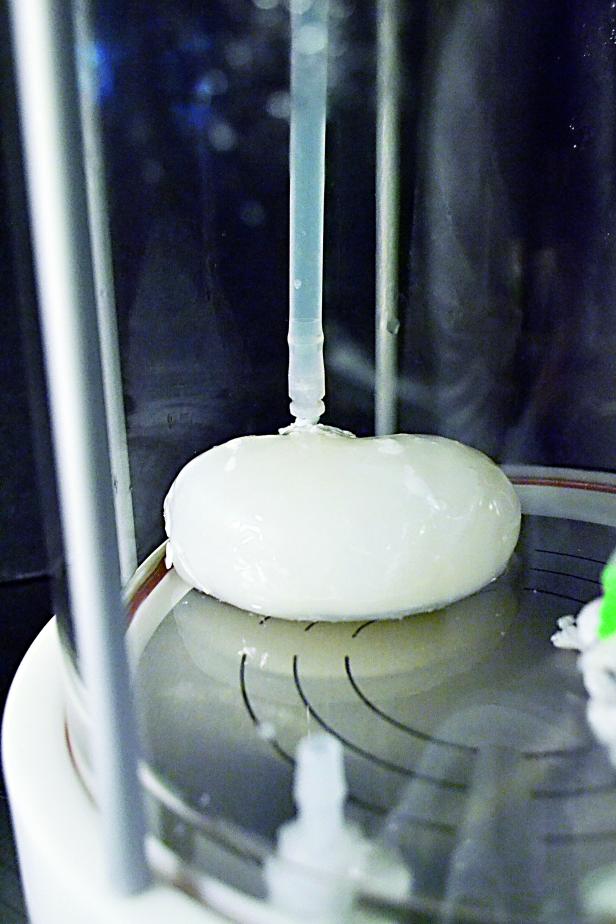
Eine weiße, runde Masse wird in einem Laborgefäß mit einer Pipette beträufelt.
Entzellte Schweinsniere. Ein Lösungsmittel spült die Zellen aus, die Struktur bleibt übrig.
profil: Wie funktioniert Ihr Konzept? Ott: Da muss ich ausholen. Ich habe in Innsbruck Medizin studiert und die Ausbildung zum Herz- Thorax-Chirurgen gemacht. Es gab damals eine Reihe von Forschern im Umfeld meines Mentors Günther Laufer, die heute alle an der Wiener Medizinuniversität tätig sind. Sie hatten Anfang der 2000er-Jahre in Rattenversuchen versucht, beschädigte Herzmuskeln durch Zellinjektionen zu reparieren. Ich habe als Assistenzarzt an diesem Projekt mitgearbeitet und unter diesem fachlichen Aspekt meinen Auslandsaufenthalt geplant. So lernte ich an der University of Minnesota Doris Taylor kennen, eine der führenden Forscherinnen auf dem Gebiet der Herzzelltherapie. Mein Plan war, die Zelltherapie so weit zu entwickeln, dass ich nach meiner Rückkehr nach Österreich mit klinischen Studien beginnen könnte.
Auf Einladung der Wiener Ärztekammer hält Ott am Donnerstag, 30. November um 19:30 Uhr im Wiener Palais Lobkowitz einen Vortrag über seine Forschungen.
profil: Aber die Zelltherapie war doch ein Fehlschlag? Ott: Unsere Vorstellung war, dass man einzelne Zellen in den geschädigten Herzmuskel injiziert, wo sie mit der Gewebsregeneration beginnen würden. Aber das wäre so, als wollte man ein zerstörtes Haus wieder aufbauen, indem man einfach Steine darauf wirft. Damit lässt sich keine neue Architektur herstellen.
profil: Was haben Sie stattdessen gemacht? Ott: Uns wurde bewusst, dass wir eine dreidimensionale Struktur brauchten, die das Format des Organs repräsentierte. Da uns keine Herstellungsmethoden für eine solche Struktur zur Verfügung standen, wollte ich versuchen, die Struktur aus bestehenden Organen zu isolieren. Für diesen Zweck habe ich die Perfusions-Dezellulisierung erfunden.
profil: Dabei werden die Zellen aus dem kranken Gewebe gespült. Ott: Ja, mit einer Flüssigkeit. Ich habe alle möglichen Flüssigkeiten ausprobiert und schließlich herausgefunden, dass die gängige Seifenlösung SDS (Natriumdodecylsulfat, Anm.) als Spülmittel funktioniert . Das ist ein Tensid, das auch im Shampoo oder im Geschirrspülmittel enthalten ist.
profil: Und dieses Tensid löst die Zellen auf oder nur aus der Struktur heraus? Ott: Im ersten Schritt werden die Zellen durch den osmotischen Stress aufgebrochen, im zweiten aufgelöst. Dadurch war es uns möglich, die verbleibende Struktur aus Bindegewebe und Blutgefäßbaum wieder mit lebenden Herzmuskelzellen zu besiedeln. Diese Forschungen haben wir in den Jahren 2004 bis 2006 noch an der University of Minnesota durchgeführt. An der Harvard University habe ich dann mein Chirurgiestudium abgeschlossen und nebenbei meine Organexperimente fortgesetzt.
profil: Wie wollten Sie das nackte Gerüst eines Rattenherzens wieder mit lebenden Herzzellen besiedeln? Ott: Wir haben das Herzgerüst zunächst nur mit Zellen aus neugeborenen Ratten besiedelt. Kritiker sagten, diese Versuche seien klinisch völlig irrelevant, weil man ja nie humane Föten zerlegen wird, um ein Menschenherz zu regenerieren. Dazu kommt, dass ein solches Herz vom Empfänger abgestoßen würde, weil es von einem anderen Individuum stammt.
profil: Also experimentierten Sie in Harvard an allen möglichen Organen? Ott: Ja, Lungen, Nieren, Pankreas. Gleichzeitig publizierte der japanische Stammzellforscher Shin'ya Yamanaka seine Studie über die von ihm entwickelten induzierten pluripotenten Stammzellen -ein Meilenstein in der Zelltherapie, für den Yamanaka 2012 den Medizin-Nobelpreis erhielt.

Ein konserviertes Herz liegt in einer Metallwanne neben einem Lineal.
Kunstherz. Im Experiment begannen menschliche Zellen zu pulsieren – ein erhebender Moment.
profil: Es war ihm gelungen, Zellen eines erwachsenen Lebewesens zu reprogrammieren, also gleichsam zum Ausgangspunkt ihrer Entwicklung zurückzudrehen. Diese Zellen haben laut Yamanaka die gleichen Eigenschaften wie embryonale Stammzellen und können sich daher zu jeder Art Körperzelle neu entwickeln. Ott: Damit hat er eine Technologie erfunden, die es uns möglich macht, Stammzellen vom einzelnen Patienten herzustellen. Da wir in Harvard in einem Epizentrum der Stammzellforschung beheimatet sind, konnten wir vom ersten Tag an mit Yamanakas Stammzellen experimentieren. Das lenkte unsere Forschungsarbeit in Richtung personalisierte Medizin, also Züchtung von maßgeschneiderten Organen für den einzelnen Patienten.
profil: Dabei kam Ihnen noch eine weitere Entdeckung zugute, nämlich die Möglichkeit, reprogrammierte, also in den Embryonalzustand versetzte Körperzellen dazu zu bringen, sich in eine bestimmte Richtung zu entwickeln, also etwa zu einer Herz-, Nieren-, Leber-oder Nervenzelle. Ott: Man nennt das gelenkte Differenzierung.
profil: Da die reprogrammierten Zellen die gleichen Eigenschaften haben wie embryonale Stammzellen und es außerdem möglich ist, zu bestimmen, zu welcher Art Körperzelle sie sich entwickeln, könnte man sie dann nicht gleich dazu anleiten, ein ganzes Organ zu bilden? Ott: Man kann durchaus quasi im Häferl Stammzellen dazu bewegen, sich in Richtung Organ zu entwickeln. Aber man muss sich das praktisch vorstellen, wie lange es braucht, bis ein solches Organ eine transplantierbare Größe erreicht: vom fetalen Stadium über das Baby-, Kindes-und Jugend-bis zum Erwachsenenalter. Das sind so viele Jahre Entwicklungszeit, dass das völlig unrealistisch ist.
profil: Aber, vom Zeitfaktor abgesehen, völlig ausgeschlossen ist es nicht, ein Organ auf diese Weise im Labor zu züchten? Ott: Man hat heute auch noch nicht die Möglichkeit, die nötige Umgebung für die Zellen herzustellen. Unsere Gruppe arbeitet die meiste Zeit daran, diesen Prozess der Gewebeformation besser zu verstehen und herauszufinden, wie man ihn auf die Gesamtorgane umlegen kann.
profil: Was war der nächste Schritt, nachdem Sie ein Rattenherz von seinen Zellen befreit hatten? Ott: Der nächste Schritt war die Konstruktion eines Bioreaktors, der die Züchtung eines solchen Organs im durchbluteten Zustand ermöglicht. Mit dieser Maschine haben wir das Organgerüst samt intakten Blutgefäßen mit Herzzellen von Rattenföten besiedelt. Dabei ist es innerhalb weniger Tage gelungen, kontrahierende Herzmuskelzellen herzustellen.
profil: Mit diesem Experiment wurden Sie weltweit bekannt. Ott: Dabei war es ein einfaches Konzept. Die Frage lautete: Ist es möglich, ein Rattenherz zu zerlegen und dann auf dem richtigen Gerüst wieder zu einem funktionellen Gewebe zusammenzubauen?
profil: Dazu benötigen Sie eine Blutversorgung, um die angesiedelten Zellen zu ernähren und mit Sauerstoff zu versorgen. Ott: Zu diesem Zweck verwenden wir Zellkulturmedien, die Nährstoffe enthalten. Ein wichtiger Aspekt dieser Forschung ist es, dass es möglich war, ein Gerüst herzustellen, das einen intakten Blutgefäßbaum hat. Durch dieses Gefäßsystem bringen wir Nährstoffe und Sauerstoff zum entstehenden Gewebe und halten die Zellen am Leben. Erst dadurch ist es später möglich geworden, unsere Experimente auf die wesentlich größeren humanen Strukturen zu übertragen.

Eine Grafik zeigt Organtransplantationen in Österreich im Jahr 2015 nach Organ und Warteliste.
Mehr Bedarf als Spender. In Österreich warten Hunderte Patienten auf Spenderorgane, vor allem auf Nieren.
profil: Vorerst blieb es aber noch bei Kleintierversuchen? Ott: An der Harvard University begann ich damit, ein eigenes Labor für meine Experimente aufzubauen. Dort wollten wir zeigen, dass sich unsere am Rattenherz entwickelte Technologie auch auf andere Organsysteme anwenden lässt.
profil: Und das hat funktioniert? Ott: Erst nach einiger Entwicklungsarbeit. 2010 wiederholten wir das ursprüngliche Experiment an Rattenlungen. Wie zuvor beim Rattenherz gelang es uns, das Organ zu dezellulieren und mit neuen Lungenzellen zu besiedeln, sodass wieder ein funktionelles Gewebe entstand. 2013 erprobten wir das Ganze auch an Nieren und Bauchspeicheldrüsen von Ratten. Das waren wichtige Schritte, die zeigten, dass es sich um eine Plattformtechnologie handelt, die auf alle Organe anwendbar ist. Der wichtige nächste Schritt bestand darin, zu zeigen, dass es möglich ist, das Gleiche auch mit humanen Zellen zu machen, auf humaner Größe.
profil: Anhand welcher Organe? Ott: Wir testeten unsere Technologie zuerst an humanen Herzen und an Schweineherzen, später auch an Menschen-und Schweinelungen. Weil wir den Gefäßbaum intakt halten, ist es uns möglich, Gewebe von humaner Größe herzustellen. Das Herzmuskel-oder Lungengewebe muss ja durchblutet werden, sonst hat man einen Herz-oder Lungeninfarkt im Reagenzglas.
profil: Ist es Ihnen nur gelungen, humane Herzmuskeln oder Herzklappen zu entwickeln? Ott: Das Bindegewebe der Herzklappen ist in diesen Gerüsten intakt, aber in den ersten Schritten haben sich unsere Forschungen primär darauf konzentriert, Herzmuskelgewebe mit frischen Zellen anzureichern.
profil: Das dann auch zu pulsieren begann? Ott: Ja, so wie wir es erwartet hatten. Sie können sich vorstellen, was für ein erhebender Moment das für uns war. Das Wesentliche ist, dass es uns gelungen ist, aus einem humanen Organ ein humanes Gerüst herzustellen, dieses Organgerüst mit humanen Zellen zu besiedeln und wieder in eine funktionierende Form zu bringen.
profil: Das klingt alles fantastisch, aber wie sicher sind Sie, dass Ihr Konzept am Ende aufgehen wird? Denn jetzt müssen wohl noch viele Forschungsschritte folgen, um ein funktionierendes und klinisch anwendbares humanes Organ zu erzeugen? Ott: Ich bin absolut davon überzeugt, dass es uns gelingen wird, Organe und Gewebe von humanen Stammzellen herzustellen. Mittlerweile hat sich ungeheuer viel in der Stammzellen-und in der angewandten Entwicklungsbiologie getan, sodass ich sehr optimistisch bin. Das gesamte Forschungsgebiet versucht natürlich massiv, in die klinische Anwendung zu kommen. Das ist der nächste logische Schritt. Wenn das Autoradio kaputt ist, repariert das kein Mensch mehr, sondern das alte Radio wird gegen ein neues ausgetauscht. Und im gleichen Sinne wird es uns möglich sein, menschliche Organsysteme herzustellen, die ausgetauscht werden. Ob es letztlich auf unserem Gerüst hergestellt oder auf einem 3D-gedruckten Gerüst aufgebaut wird, wird sich mit der Zeit herausstellen.
profil: Es gibt ja schon 3D-Drucker für Bio-Materialien. Ott: Die Geräte können biologische Zellen, eine Matrix oder auch Organgerüste herstellen. Das ist alles schön und gut, aber um eines dieser Gebiete oder uns alle zum Erfolg zu bringen, müssen wir die Biologie des Organzusammenbaus verstehen. Und das ist die Hausaufgabe für die nächsten zehn Jahre. Ein japanischer Post-Doc aus meiner Forschungsgruppe hat erst vor einigen Wochen bei einem Kongress in Wien unser Lungen-Transplantations-Projekt vorgestellt. Dabei ist es uns gelungen, auf Schweinelungengerüsten humane Lungen herzustellen und diese ins Schwein zu transplantieren. Die ersten Schritte im Großtierversuch sind also schon gemacht. Das Problem dabei ist noch, dass die Reife dieser Gewebe noch nicht gut genug ist, um letztendlich in die klinische Anwendung zu kommen. Es wird noch zehn Jahre dauern, bis uns das möglich sein wird.
profil: Was ist Ihr persönliches Ziel als Forscher? Ott: Wenn ich es in meiner Berufslaufbahn schaffe, ein funktionierendes Organ in einen Menschen zu bringen, wäre ich zufrieden. Aber das hängt nicht allein vor mir oder meiner Forschungsgruppe ab, sondern von der Reife eines ganzen Forschungsgebiets.
Zur Person:
Harald C. Ott, 40, war während seiner Ausbildung zum Herz-Thorax-Chirurgen in Innsbruck auch an ersten Versuchen einer Zelltherapie beteiligt. Er ging an die University of Minnesota, ein Zentrum der Zelltherapie, und entwickelte dort ein Verfahren, um mithilfe eines Lösungsmittels Zellen aus kranken Rattenherzen zu spülen, sodass man die verbliebene Struktur wieder mit gesunden Zellen besiedeln konnte. Heute leitet er an der Harvard University in Boston ein eigenes Forschungslabor, das Ott Lab, das sich mit der "Züchtung" von Ersatzorganen für chronisch kranke Menschen befasst.