Labor bei der a:head bio AG
An Organoiden können Tausende Wirkstoffkandidaten systematisch getestet werden.
Können im Labor gezüchtete Hirne Tierversuche ersetzen?
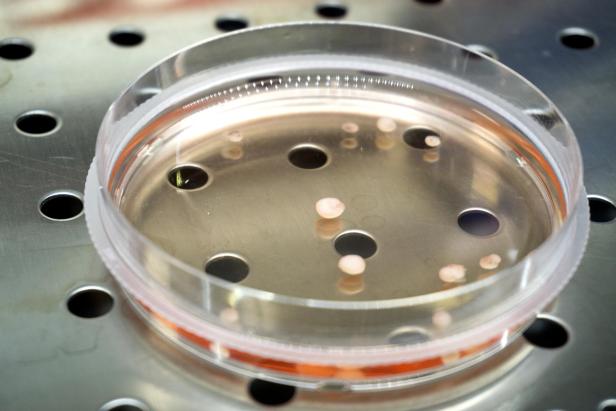
Die kleinen blassrosa Bällchen schweben in einer Nährflüssigkeit und erinnern entfernt an Linsen. Tatsächlich handelt es sich bei den etwa fünf Millimeter messenden rundlichen Gebilden in der Petrischale um die Essenz dessen, was uns Menschen ausmacht: um eine Ansammlung von Nervenzellen, die ein winziges Gehirn bilden. Zerebrale Organoide heißen diese dreidimensionalen Zellstrukturen. Es sind Miniaturausgaben echter Organe, stark reduzierte Labornachbildungen humanen Hirngewebes, die aber Eigenschaften eines realen menschlichen Gehirns besitzen: Die Neuronen vernetzen sich, erzeugen und übertragen elektrische Signale und können Hirnareale wie Kortex und Mittelhirn ausprägen.
Einige Tausend solcher Organoide wachsen in den Laboren des Wiener Biotechnologie-Start-ups a:head bio AG heran und durchlaufen dabei mehrere Stadien: von einzelnen Zellen zu Beginn des Prozesses über winzige Zellhäufchen nach ein paar Tagen bis zu erstaunlich komplexen Minigehirnen mit mehreren Millionen Nervenzellen nach vier Monaten. „Anhand der Organoide können wir die Funktionen eines menschlichen Gehirns studieren und verschiedene Krankheiten nachbilden“, sagt Oliver Szolar, einer der Gründer des Unternehmens. „Wir beobachten die Kommunikation der Neuronen und können sogar jede einzelne Nervenzelle sichtbar machen.“
Mittelfristig ist der Plan, an die 100.000 Organoide automatisiert zu kultivieren. An diesen Gehirnmodellen wollen die Forscherinnen und Forscher neue Wirkstoffe gegen gravierende neurologische Erkrankungen wie Epilepsie testen. Mit bisherigen Methoden ist dies kaum möglich: Traditionell stehen dafür fast nur Tierversuche zur Verfügung – und diese sind erstens ethisch strittig und zweitens bedingt brauchbar, weil Erkenntnisse, die von Mäusen oder Ratten stammen, nur begrenzt auf den Menschen übertragbar sind. Die Folgen kennt die Ärzte- wie auch die Patientenschaft: Es mangelt an modernen effektiven Medikamenten gegen schwere Hirnerkrankungen.
a:head ist eine Ausgründung des Instituts für Molekulare Biotechnologie der Akademie der Wissenschaften (IMBA) und am Campus des Vienna Biocenter im 3. Wiener Bezirk angesiedelt, eines der bedeutendsten biomedizinischen Forschungszentren Europas. Am selben Standort konzentriert sich Jürgen Knoblich auf die Grundlagenforschung zum Thema. Knoblich ist Direktor des IMBA und einer der internationalen Pioniere auf dem Gebiet der GehirnOrganoide. Vor genau zehn Jahren gelang ihm zusammen mit seiner damaligen Mitarbeiterin Madeline Lancaster ein Durchbruch, der unter die weltweit zehn bedeutendsten wissenschaftlichen Entdeckungen gereiht wurde. Knoblichs Forschungsgruppe hatte ein neues Verfahren entwickelt, um Gehirn-Organoide herzustellen und zur Untersuchung einer neurologischen Krankheit zu nutzen.
Das Rohmaterial bestand aus pluripotenten Stammzellen: Körperzellen, die sich noch zu jeder Art von Gewebe entwickeln können – ob Muskel-, Blut-, Knochen- oder eben Gehirnzellen. Die Herausforderung bestand darin, diese Stammzellen in einem geeigneten Umfeld so zu lenken, dass sie Nervenzellen bilden und sich in Richtung Gehirn entwickeln. Dazu benötigt man zwar technologisch ausgereiftes Labor-Equipment, doch zugleich verläuft dieser Prozess geradezu bestechend einfach. Es braucht ein Nährmedium mit Wachstumsfaktoren wie Vitaminen, Fetten, Zucker und Proteinen, in welches die Stammzellen eingebracht werden. Darin formen sie das Neuroektoderm, einen Vorläufer des Nervensystems. Diesen transferieren die Forschenden in eine Substanz namens Matrigel, die man sich, so Knoblich, ein wenig wie Gelatine vorstellen kann.
Das Verblüffende ist, dass der Rest des Prozesses beinahe automatisiert verläuft. „Selbstorganisation“ nennen dies die Wissenschafter: Nach und nach wächst ein Gehirn-Organoid heran wie in den Labors von a:head (siehe Grafik links). Madeline Lancaster, die mittlerweile am MRC Laboratory of Molecular Biology in Cambridge forscht, vergleicht dies in einem Fachartikel mit dem Gärtnern: Man müsse den Boden bereiten, für Licht, Feuchtigkeit und Dünger sorgen. Doch letztlich wachsen die Pflanzen von selbst. Ganz ähnlich sei das bei zerebralen Organoiden. Besonders bemerkenswert ist dabei eine natürliche Tendenz von Stammzellen, Gehirngewebe zu bilden. „Wenn man den Zellen keine andere Anweisung erteilt, formen sie Nervenzellen“, sagt Knoblich.
„An den Organoiden können wir Funktionen des Gehirns studieren.“
Oliver Szolar, a:head bio AG
Die Wiener Forschenden, die ihre Methode 2013 im Fachjournal „Nature“ beschrieben, züchteten nicht nur die ersten Hirn-Organoide. Sie erzeugten außerdem solche, die die genetische Ausstattung für eine gravierende neurologische Erkrankung besaßen: für Mikrozephalie, ein Leiden, das sich in deutlich verringerter Gehirngröße niederschlägt. Das Team um Knoblich entnahm dafür zunächst Hautzellen eines Patienten und führte diese ins pluripotente Stadium zurück. Solch eine Reprogrammierung gelingt, vereinfacht ausgedrückt, indem man genetisch verschlossene Türen öffnet. Im Zuge der Körperentwicklung kommt es zu einer Spezialisierung der Zellen, zum Beispiel in Leber- oder Nierenzellen. Andere Pfade, welche die Zelle einschlagen könnte, werden dabei verschlossen. Mit molekularbiologischen Methoden ist es aber möglich, diese abgesperrten Bereiche wieder aufzuschließen – und die Zelle in den pluripotenten Ausgangszustand zurückzuversetzen.
Damit ließen Knoblich und seine Forschungsgruppe anschließend Organoide des Mikrozephalie-Patienten wachsen. In der Petrischale konnten sie ein winziges Abbild dessen studieren, was im Menschen geschieht: Die Organoide des Patienten waren merklich kleiner als solche aus gesunden Körperzellen. An Miniaturorganen lassen sich somit die Auswirkungen schwerer genetischer Leiden untersuchen – und eines Tages vielleicht auch heilen. Denn mittlerweile, so Knoblich, „kommen mehrere neue Technologien zusammen, die uns helfen, die Biologie des Menschen besser zu verstehen“.
Heute genügen eine Hauptbiopsie oder eine Blutprobe, um Zellen eines Patienten zu gewinnen. Eine komplette Genomanalyse, die das Muster einer genetischen Erkrankung verrät, dauert nicht mehr länger als eine Woche. Und mithilfe der Genschere CRISPR/Cas9, die gezielte Eingriffe ins Genom erlaubt, ließen sich problematische Gene entfernen. Studien an Organoiden können dazu dienen, solche „Reparaturen“ zu erproben.
Doch Organoide helfen schon allein beim umfassenderen Verständnis krankhafter Prozesse. Als ab 2015 das Zika-Virus eine schwere Epidemie in Südamerika auslöste, nutzten Forschergruppen die Methode von Knoblich und Lancaster, um einen Verdacht zu überprüfen. Mediziner hatten eine beunruhigend hohe Zahl an Neugeborenen mit Gehirnfehlbildungen registriert, was zur Frage führte: Verursacht das Virus bei ungeborenen Kindern Mikrozephalie, eben jene Erkrankung, welche die Wiener Forschenden bereits 2012 erforscht hatten? An mit dem Virus infizierten Organoiden ließ sich der klare Beweis erbringen, dass tatsächlich die Infektion daran schuld ist.

„Das Gehirn ist enorm faszinierend. Dafür zahlen wir einen Preis.“
„Das Gehirn ist enorm faszinierend. Dafür zahlen wir einen Preis.“
Jürgen Knoblich, Molekularbiologe
Auch die Auswirkungen anderer Infektionskrankheiten, darunter des Grippe-, des Respiratorischen Synzytial- und des Coronavirus, konnten mittlerweile im Detail an Organoiden beobachtet werden. Nach demselben Prinzip kann auch das Gefährdungspotenzial von Giftstoffen untersucht werden. Je nach Körpergewebe, das von Viren oder toxischen Substanzen angegriffen wird, verwenden Forschende dafür unterschiedlichste Organoide. Denn ebenso, wie sich Gehirnorganoide züchten lassen, können auch solche aus Lungen-, Leber- oder Darmzellen hergestellt werden.
Zahlreiche wissenschaftliche Institutionen in aller Welt konzentrieren sich inzwischen auf diese Technologie, doch Wien ist zweifellos ein globales Zentrum der Organoidforschung, was nicht zuletzt an der Pionierarbeit von Knoblichs Gruppe liegt. Eine andere Ausgründung des IMBA, das Start-up HeartBeat.bio, konzentriert sich auf Herz-Organoide, sogenannte Kardioide. Das Ziel ist sowohl die präzise Untersuchung von Herzerkrankungen am Labormodell als auch die Suche nach neuen Medikamenten. Und am Institute of Science and Technology Austria (ISTA) bei Klosterneuburg arbeitet eine Forschungsgruppe daran, mithilfe von Organoiden den Ursachen von Autismus auf die Spur zu kommen.
Ein Schwerpunkt der Forschungen in Wien liegt eindeutig auf zerebralen Organoiden, und das hat mehrere Gründe. „Das menschliche Gehirn ist unglaublich faszinierend“, sagt Knoblich, „aber dafür zahlen wir einen Preis. Es ist anfällig für Erkrankungen.“ Rund ein Viertel aller Menschen ereilt irgendwann eine neurologische Erkrankung. Und diese Leiden sind schwierig zu beforschen: Das Gehirn, diese 1,4 Kilo schwere gelbliche Masse, sitzt gut geschützt im Schädel und ist direkten Untersuchungen kaum zugänglich. Ergebnisse aus Tierversuchen sind in diesem Fall besonders unzuverlässig, allein wegen erheblicher anatomischer Unterschiede: Das Gehirn einer Maus ist glatt, jenes des Menschen vielfach und kompliziert gefaltet. Die Miniaturorgane sind daher äußerst wertvoll, um neues Wissen zu gewinnen.
Oliver Szolar sitzt in einem Büro von a:head bio und deutet auf zwei bunte, gezackte Kurven auf seinem Laptop. Ob der Unterschied zwischen der linken und der rechten Kurve erkennbar sei, fragt Szolar. Er ist tatsächlich augenfällig: Das Muster der Ausschläge, der „activity peaks“, weicht deutlich voneinander ab. Rechts sind sie merklich gedrängter, die Spitzen und Täler der Kurve liegen viel enger beieinander als auf der linken Seite. Was hat das zu bedeuten? Die Kurven zeigen die elektrischen Aktivitätsmuster eines Organoids vor und nach Behandlung mit einem krampfauslösenden Mittel. Rechts sieht man gewissermaßen eine Nachbildung von Epilepsie, und hier zeigt sich eine deutlich höhere Erregung.
Das Forschungsteam um Szolar züchtet nicht bloß Organoide in hoher Zahl, es entwickelt auch Methoden, um neurologische Erkrankungen sicht- und messbar zu machen – in den vier bis fünf Millimeter großen Zellhäufchen in den Petrischalen und sogar in jeder einzelnen Nervenzelle darin. „Wir sehen, wie oft die Neuronen feuern und analysieren deren Netzwerkaktivität im Detail“, erklärt Szolar. Daraus lassen sich Erregungsmuster ableiten, und bei Organoiden von Epileptikern sehen diese deutlich anders aus als bei jenen von gesunden Personen.
Wie misst man die Aktivität einer Nervenzelle? Die Expertengruppe kennt zwei Methoden: Zum einen lässt sich mit molekularbiologischen Methoden ein Gen in die Organoide einbringen, das wiederum ein Protein produziert. In Gegenwart von Kalzium beginnt, dieses Eiweiß Licht zu emittieren und dadurch die Aktivität der Neuronen zu verraten. Die zweite Möglichkeit beruht auf Elektrizität: Die Organoide werden dabei auf Träger aufgebracht, die den Chips einer Kamera ähneln und mit Elektroden bestückt sind. Die Aktivitätsmuster äußern sich in diesem Fall in elektrischen Signalen.
Das Wiener Life-Science-Unternehmen, das sich bei seinen Forschungen mittlerweile auf Risikokapital und öffentliche Förderungen stützt, hat ein beständig wachsendes Arsenal aus Organoiden zur Verfügung und konzentriert sich derzeit darauf, die gewonnenen Erkenntnisse in eine automatisierte Plattform zu übertragen. Ziel ist es schließlich, dieses Wissen zur Suche nach potenziellen Wirkstoffkandidaten gegen neurologische Erkrankungen einzusetzen. „Wir versuchen, schon in der frühen Phase der Medikamentenentwicklung, die klinische Situation so gut wie möglich zu spiegeln. Dadurch sollen schließlich mehr und bessere Medikamente beim Patienten ankommen und die gesamte Entwicklung aufgrund höherer Erfolgsraten auch kostengünstiger werden“, sagt Szolar. Das eigentliche Ziel lautet daher, mithilfe der Organoide neue therapeutische Strategien gegen neurologische Leiden wie Epilepsie zu identifizieren.
Denn die herkömmliche Medikamentenentwicklung ist mit speziellen Hürden konfrontiert: Traditionell stehen Proteine, Zellkulturen sowie Tierversuche zur Verfügung, um geeignete Wirkstoffkandidaten aufzuspüren und sie zunächst auf Effektivität und Verträglichkeit zu testen und zu optimieren. Diese Substanzen müssen anschließend in großen Patientenstudien in mehreren Phasen getestet werden – ein langwieriges Prozedere, das Milliarden verschlingen kann. Das Problem dabei: Zell- und Tierstudien bilden eben nur sehr eingeschränkt ab, was tatsächlich im menschlichen Organismus geschieht. Eine Folge kann sein, dass sich die Hoffnungen, die zunächst in eine Wirksubstanz gesetzt wurden, letztlich bei den Patientenstudien nicht erfüllen.
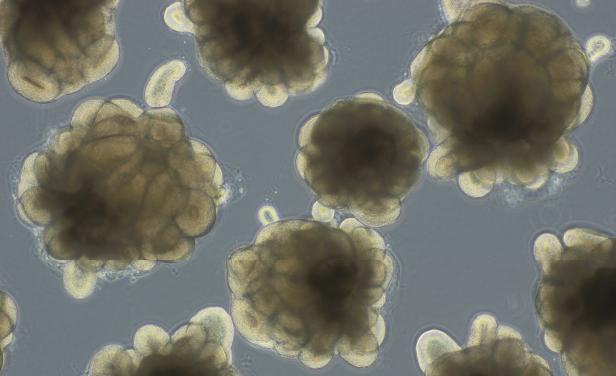
Gehirn-Züchtung
Die Organoide können dazu dienen, neue Wirkstoffe gegen schwere neurologische Erkrankungen zu erproben.
Die Idee ist nun, die Identifizierung neuer Medikamente mithilfe von Organoiden grundlegend zu verändern. Die Forschenden konzentrieren sich dabei auf die sogenannte präklinische Phase: auf jene Etappen vor den großen klinischen Studien, in denen es darum geht, Wirkstoffe zu finden und zu testen. Der große Vorteil bestünde mit einiger Wahrscheinlichkeit darin, dass Tests an Organoiden lebensnahe Ergebnisse liefern – und die folgenden Patientenstudien dadurch höhere Erfolgsaussichten haben.
Systematisch und automatisiert wollen die Forschenden mit der Zeit Tausende oder sogar Hunderttausende Wirkstoffe an den Organoiden prüfen. Darunter könnten auch Substanzen sein, die bei neurologischen Krankheiten bisher noch gar nicht in der Ziehung waren. Denn immer wieder entfalten Medikamente in anderen als den für sie angedachten Bereichen überraschend Wirkung.
Die Hoffnung besteht darin, mit diesen systematischen Screenings „Hits“ zu landen: Präparate aufzuspüren, die beispielsweise gegen Epilepsie wirken. Genau wie die epilepsiebedingte Übererregung anhand der Aktivitätskurven ablesbar ist, sollte erkennbar sein, wenn ein bestimmter Wirkstoff die Aktivität Richtung Normbereich verschiebt – was ein Hinweis auf Wirksamkeit und Ausgangspunkt für neue Medikamente sein könnte.
Zwar handle es sich nicht um Tests an „echten“ Menschen, fügt Szolar hinzu. Doch immerhin werden Millionen von Zellen studiert, in denen im Prinzip dieselben Prozesse ablaufen wie in einem lebendigen Organismus. Klinische Studien müssten im Anschluss natürlich trotzdem durchgeführt werden, doch die Phasen davor könnten revolutioniert werden – durch Verzicht auf Tierversuche sowie die Möglichkeit, Hunderttausende potenzielle Wirkstoffkandidaten im Labor zu screenen. Und außerdem durch die Option, Medizin maßgeschneidert zu entwickeln, indem man Wirkstoffe an den Organoiden eines konkreten Patienten prüft.
Ethische Einwände gegen die Gehirne im Labor erheben sich kaum. Denn zum einen kommen nicht die heiklen embryonalen Stammzellen zum Einsatz, sondern eben Blut- oder Hautzellen erwachsener Personen, die der Entnahme zustimmen. Zum anderen, so Knoblich, züchte man keine „Humanoide“: keine kleinen Menschen im Labor. Die Organoide besitzen weder Blutgefäße noch sind sie in der Lage, sensorischen Input zu empfangen. Es handelt sich also lediglich um isolierte Mini-Organe ohne jede Verbindung zur Außenwelt.
Genau dies könnte zugleich eine Einschränkung der Aussagekraft von Organoid-Studien bedeuten, wie Skeptiker meinen: Weil die Zellstrukturen eben nicht in einen kompletten Organismus samt Blut-, Immunsystem und Sinneswahrnehmung eingebettet sind, repräsentieren sie auch keinen lebendigen Menschen. Das mag zutreffen, allerdings gilt dies für Tierversuche erst recht. So stellen Organoide vielleicht die bisher größtmögliche Annäherung an die Realität dar.