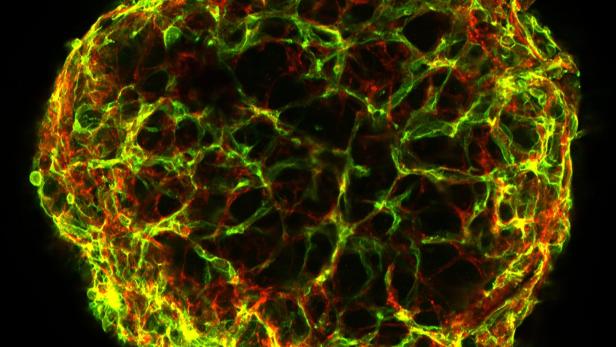
Ein Blutgefäß-Organoid leuchtet grün und rot auf schwarzem Hintergrund.
© Angios Biotech
Ein Blutgefäß-Organoid leuchtet grün und rot auf schwarzem Hintergrund.
Genschere, Organoide, Proteine, mRNA: Die Medizin der Zukunft
Schriftgröße
CRISPR: Mit der Genschere gegen Erbkrankheiten
Gerade noch war es eine Zukunftsvision, nun erreichen Therapien mit der Genschere CRISPR/Cas9 der Reihe nach die Praxis. Entwickelt von Emmanuelle Charpentier (Bild unten), die auch am Vienna Biocenter forschte, und Jennifer Doudna, lässt sich mit der Genschere gezielt das Erbgut bearbeiten: Zunächst wird eine gewünschte Stelle darin angesteuert, mithilfe des Enzyms Cas9 dann der DNA-Strang durchtrennt – und ein anvisiertes Gen ausgeschaltet. So lassen sich fehlerhafte Gene lahmlegen, die zu gravierenden Krankheiten führen. Damit glückte zunächst die Behandlung von Sichelzellanämie, einem Erbleiden, bei dem zu wenig Blutfarbstoff gebildet wird. Im Mai gelang es, bei einem zehn Monate alten Kind eine Mutation zu korrigieren, die oft zum Tod führt: Diese bewirkt, dass giftiger Ammoniak entsteht und das Gehirn schädigt. Ebenfalls im Mai bearbeiteten Forschende bei einem Teenager ein Gen, welches das Immunsystem schwer beeinträchtigt. Noch sind das Einzelfälle, doch sie zeigen: Die Medizin hat nun ein Instrument, um schwere Erbleiden gleichsam abzuschalten.

Emmanuelle Charpentier
© AFP/APA/AFP/TOBIAS SCHWARZ
Emmanuelle Charpentier
Organoide: Warum Forschende im Labor Gehirne züchten
Es beginnt mit Stammzellen, die in einem Nährmedium zu Nervengewebe heranreifen – zu einige Millimeter großen rosa Bällchen, Miniaturausgaben von Teilen des menschlichen Gehirns. An diesen Gehirn-Organoiden studiert der Molekularbiologe Jürgen Knoblich (unten) mit seinem Team am Wiener Institut für molekulare Biotechnologie neurologische Leiden wie Autismus, Parkinson und Epilepsie. In den Organoiden laufen exakt dieselben Prozesse ab wie im lebenden Menschen, sodass sich präzise Modelle neurologischer Krankheiten nachbilden lassen. Knoblich gelang es bereits, bestimmte Zelltypen aufzuspüren, die eine schwere Form von Epilepsie verursachen. Ebenso züchteten die Forschenden Hirnareale, die bei Parkinson entscheidend sind, und sie testeten, welche Mutationen mit bestimmten Varianten von Autismus einhergehen. Organoide erlauben es, in realitätsnahen Labormodellen die molekularen Auslöser gravierender Leiden aufzuspüren – und werden daher Basis für viele Therapien der Zukunft sein.
Regeneration: Können Körperteile nachwachsen?
Vor 20 Jahren war es ein exotisches Randgebiet, heute ist es ein Trendthema der Forschung, sagt Elly Tanaka (unten): Die Biochemikerin, Direktorin des Wiener Instituts für Molekulare Biotechnologie und seit heuer Wittgenstein-Preisträgerin, studiert die Regenerationsfähigkeit von Körpergewebe – inspiriert vom Axolotl, einer Salamanderart, der ganze Körperteile nachwachsen. Die Tiere profitieren, wie Tanaka zeigen konnte, von einer Rückentwicklung von Zellen in ein embryoähnliches Stadium. Aus diesen jungen Zellen kann sich neues Gewebe bilden. Besitzt auch der Mensch molekulare Schalter, die Ähnliches erlauben würden, aber außer Funktion sind? Könnten sich diese Schalter aktivieren lassen und beim Menschen ebenfalls Regeneration ermöglichen, etwa von Haut oder Knochen nach Verletzungen? Tanaka geht es um Grundlagenforschung, es schwingen aber durchaus künftige Anwendungen mit. In Summe, meint sie, werden all die neuen Konzepte der Biotechnologie zu „einer Revolution der Medizin führen“.
mRNA-Technologie: Impfungen gegen HIV und Krebs
Erst Anfang August erbrachten Tests eines HIV-Impfstoffs auf mRNA-Basis positive Ergebnisse, und ähnliche Erfolge wurden zuletzt aus mehreren Studien vermeldet, die mRNA-Vakzine gegen Infektionskrankheiten prüften. Zugleich nähert sich die Technologie, bekannt durch die Covid-Impfstoffe, ihrem ursprünglichen Ziel: der Entwicklung neuartiger Therapien gegen Krebs. Das war die Idee von Forschenden wie der Biochemikerin und Nobelpreisträgerin Katalin Kariko, als sie in den 1970er-Jahren begannen, das von der Natur abgeschaute Prinzip der messenger-Ribonucleic Acid (mRNA) für die Medizin nutzbar zu machen: Dabei verfasst man eine molekulare Botschaft, eine per Impfung verabreichte Bauanleitung für Proteine, die der Körper in seinen Zellen selbst herstellt. Im Fall von Krebs sind das genetische Schlüsselstellen im Krebsgewebe eines Patienten. Diese dienen als Erkennungsmerkmale für das Immunsystem, das anschließend die Krebszellen bekämpft. Es handelt sich somit um eine komplett individualisierte Krebsimmuntherapie, die im Moment in Studien erprobt wird, etwa gegen Darm- und Hautkrebs – und vielversprechende Zwischenresultate zeigte.
Proteomik: Den Geheimnissen der Proteine auf der Spur
Das Versprechen klingt fantastisch: Ein einfacher Bluttest könnte künftig anzeigen, wie groß das Risiko ist, an Alzheimer, Diabetes oder am Herzen zu erkranken. Prototypen solcher Tests gibt es bereits: Sie beruhen auf der Analyse von Proteinen – von Eiweißstoffen, den Grundbausteinen allen Lebens, die zugleich für die meisten schweren Krankheiten verantwortlich sind. Ein Schlüssel zur Behandlung gravierender Leiden und einer Medizin der Zukunft liegt daher im Verständnis des Universums der Proteine, des sogenannten Proteoms. Heute hilft dabei künstliche Intelligenz wie AlphaFold, der es gelang, die Struktur Hunderter Millionen Proteine auf einen Schlag zu entziffern – wofür im Vorjahr der Chemie-Nobelpreis vergeben wurde (Bild unten: Preisträger David Baker, ausgezeichnet für das Design künstlicher Proteine). Proteine sind auch die Basis für mRNA-Baupläne, und sie können Ziele der Genschere CRISPR sein, was zeigt: Das Potenzial all der neuen Methoden der Biomedizin liegt nicht zuletzt in ihrer Kombination, unterstützt durch KI.

David Baker
© Getty Images/Alika Jenner/Getty Images
David Baker
Blutgefäßzüchtung: Wirkstofftests ohne Tierversuche
Es klingt wie Magie, beruht aber auf forschungsintensiver Biomedizin: Angios Biotech in Innsbruck züchtet aus Stammzellen Blutgefäße im Labor, die in Studien Erfolge bei der Wundheilung zeigen und vor allem Diabetikern helfen sollen: Eine Komplikation bei diesen Patienten sind offene Wunden, die mitunter Amputationen erfordern. Die gezüchteten Blutgefäße werden direkt auf Wunden aufgebracht, verwachsen selbstständig mit dem Körpergewebe und schließen die Wunden. Das Team um Gründer Gregor Wick (im Bild unten sitzend links) und Forschungsleiter Teodor Yordanov (ganz rechts) hat noch weitere Ziele: An den Blutgefäß-Organoiden können neue Wirkstoffe getestet werden, etwa gegen Arteriosklerose. Mit diesem Ansatz werden die Innsbrucker einer Vorgabe gerecht, die immer mehr Dringlichkeit erlangt: Medikamententests ohne Tierversuche – um Tierleid zu vermeiden, aber auch im Sinne soliderer Daten, da Ergebnisse aus Tierstudien nur bedingt auf den Menschen übertragbar sind.
Impfung gegen Krebs: Das Immunsystem als Waffe
Es zeichnet sich ein Paradigmenwechsel in der Krebstherapie ab: Forschende lenken das Immunsystem gegen Krebs- und Tumorzellen – zusätzlich zu operativen oder medikamentösen Therapien respektive dann, wenn diese versagen. Das Prinzip: Krebsgewebe eines konkreten Patienten wird genetisch analysiert, wobei man Mutationen identifiziert, die bei der Entartung von Körperzellen auftreten. Diese dienen als „Neoantigene“, als Angriffsziele für das Immunsystem, das die bösartigen Zellen bekämpft. Es gibt verschiedene Methoden solcher Immuntherapien: Manche beruhen auf Proteinfragmenten, andere auf mRNA (siehe mRNA-Technologie). Besonders in früheren Stadien von Krebserkrankungen zeigen personalisierte Krebsimpfungen gute Erfolge. Sind bereits Metastasen entstanden, ist die Zahl der Mutationen oft zu unübersichtlich für ein konkretes Angriffsziel.

Alwin Schönberger
leitet das Wissenschafts-Ressort.






